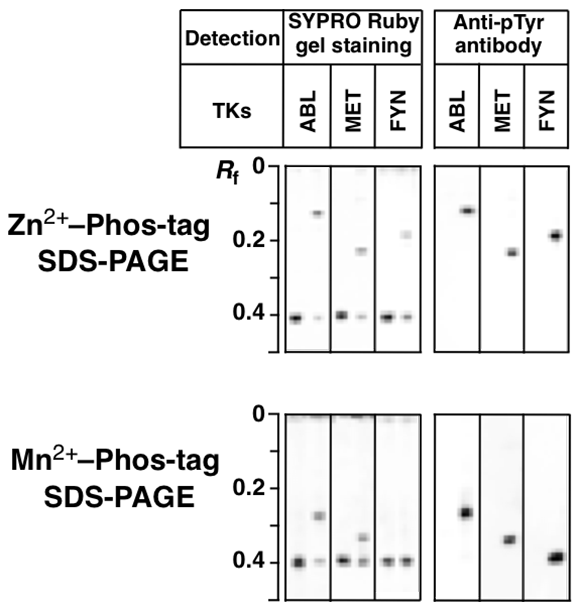
泳動結果
3種類のチロシンキナーゼ Abl, MET, FYNによる,Tau の in vitro kinase assayです。
Tau タンパク質には5つのチロシンTyr-18, -29, -197, -310, -394があります。
Abl はTyr-394
METはTyr-197
FYNはTyr-18
をリン酸化します。
Zn2+–Phos-tag SDS-PAGE で,Abl,MET, FYNによってリン酸化されたものが
それぞれ,異る移動度でシフトアップしています。
(各パネルは,反応前(左)と反応後(右)の2レーンの対比です)
抗リン酸化チロシン抗体(PY20)によるWB は,
シフトアップしたバンドがチロシンリン酸化物であることを証明しています。
Mn2+–Phos-tag SDS-PAGE で,Abl,MET によってリン酸化されたものが
シフトアップしていますが,FYNはシフトアップバンドが見られません。
Mn2+–Phos-tag SDS-PAGE ではリン酸化していてもシフトアップしない例があるが
Zn2+–Phos-tag SDS-PAGEはそのそのようなリン酸化タンパク質でも
シフトアップバンドとして検出できました。
一般に,Mn2+–Phos-tag SDS-PAGEよりも,
Zn2+–Phos-tag SDS-PAGEを用いたほうがリン酸化タンパク質の分離度が高いのですが
Zn2+–で分離検出できなくてもMn2+–で出来るケースもあるので
一概にどちらを選択するべきかは決められず,
ケースバイケースで検討するのが望ましいです。
また,この実験は
Phos-tag SDS-PAGE では分子内のリン酸化数が同じでも
リン酸化部位が異なれば,異なる移動度を示す
ということも示しています。
関連画像
Tau Tyr kinase assay(ABL, MET, FYN)_Mn2+-Phos-tag SDS-PAGE